「審査の人員増強や開発過程で相談できる制度を設ける取り組みを続けてきたこともあり、ほぼ解消されました」(PMDA広報課)
だが、日本で承認の申請にまで至らない未承認薬、つまり日本市場がスルーされた薬は、試算には含まれていない。
とはいえ、政府も未承認薬の開発を促す取り組みを進めてきた。
10年度には革新的な新薬について、特許が切れるまで薬価を維持したり下がりにくくしたりする「新薬創出加算」制度を試行的に導入。15年度には、世界に先駆けて日本で承認申請を目指す新薬の審査期間を短くできる「先駆け審査指定制度」もできた。
厚労省は、医学会や患者支援団体の要望をもとに話し合い、開発の必要性が高いと判断すれば、その薬の開発を製薬会社に促す「医療上の必要性の高い未承認薬・適応外薬検討会議」を設けている。
日本製薬工業協会(製薬協)のシンクタンク、医薬産業政策研究所の集計によると、検討会議では、21年2月までに「医療上の必要性が高い」と判断した医薬品393件の開発を企業側に要請。294件(75%)が承認に至った。
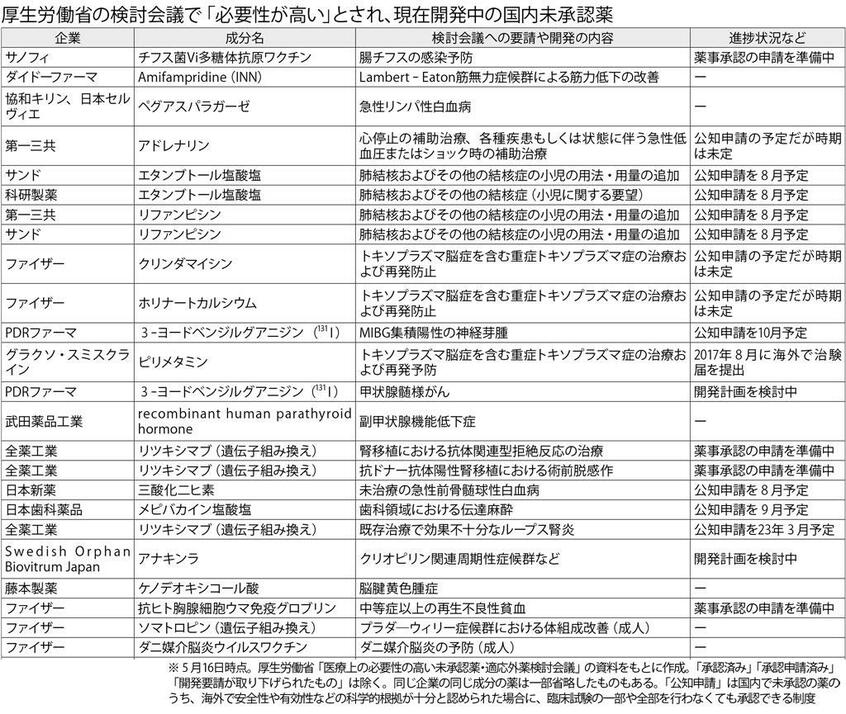
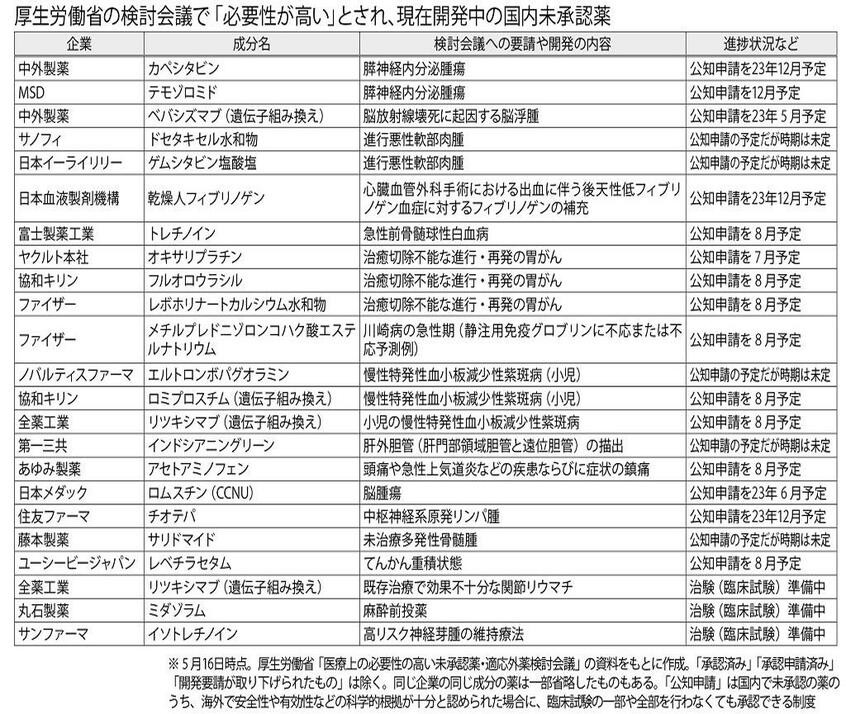
今年5月時点で承認に向けた開発が進む未承認薬・適応外薬を示したのが表だ。適応外薬は、すでに承認済みだが、国内では認められていない使い方がある薬を言う。がんだけでなく、結核やてんかんの治療薬や鎮痛剤など、さまざまな病気や用途で使える品目が増えると期待される。ただし、国立がん研究センター中央病院の副院長で先端医療科長を務める山本昇さんは検討会議について「どうしてもタイムラグが生じてしまう」と指摘する。
「海外で有望な新薬が出てきても、医学会や患者側がその情報を知り、検討会議へ要望するまでにも時間がかかる。また、せっかくの先駆け審査指定制度も海外のベンチャー企業などの間ではあまり知られていません。革新薬の適正な値段の決め方も含め、魅力的な市場にする取り組みを続ける必要があります」
製薬協は、この夏にもドラッグラグに関する詳しい分析結果を公表するという。拙速な承認はもちろん避けるべきだが、医療格差が生じぬことを願うばかりだ。(本誌・池田正史)
>>【前編】欧米新薬が日本に入らない「ドラッグラグ」が拡大 個人負担増の恐れも
※週刊朝日 2022年7月1日号より抜粋
こちらの記事もおすすめ 欧米新薬が日本に入らない「ドラッグラグ」が拡大 個人負担増の恐れも







































